Immunotherapy - The New Era of Oncology
- PMID: 29905353
- PMCID: PMC6541097
- DOI: 10.1055/s-0043-121594
Immunotherapy - The New Era of Oncology
Abstract
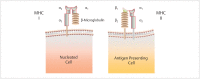
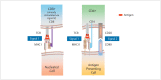
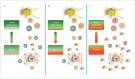
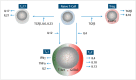
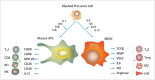
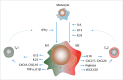
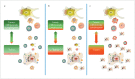
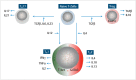
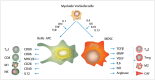
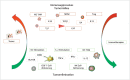
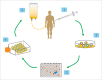
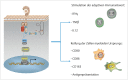
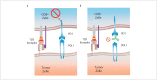
In the field of immunotherapy, essential progress was achieved over the past years partially demonstrating long lasting therapeutic responses in different tumor entities. A better understanding of the interactions between the tumor and the immune system as well as the integration of immunotherapeutic approaches into clinical routine were the foundations for this development. The different approaches intervene on multiple levels of the immune response and directly or indirectly mount the patient's own immune defense against tumor cells. Immunotherapeutic approaches are represented by cytokine therapies, vaccinations, the use of oncolytic viruses and monoclonal antibody therapies as well as adoptive cell transfer strategies.
In den letzten Jahren wurden bedeutende Fortschritte auf dem Gebiet der Immuntherapie erreicht mit teils langanhaltendem Therapieansprechen bei unterschiedlichsten Tumorentitäten. Die Basis hierfür bildet ein verbessertes Verständnis der Interaktion zwischen Tumor und Immunsystem und der damit verbundenen Integration immuntherapeutischer Ansätze in die klinische Routine. Die hierbei eingesetzten immuntherapeutischen Strategien greifen auf unterschiedlichen Ebenen der Immunantwort ein, fördern direkt oder indirekt die Zerstörung der Tumorzellen durch die körpereigene Abwehr und reichen von Zytokintherapien über Vakzinierungen und den Einsatz onkolytischer Viren bis hin zu monoklonalen Antikörpertherapien und dem adoptiven Zelltransfer.
Eigentümer und Copyright ©Georg Thieme Verlag KG 2018.
Conflict of interest statement
Die Autoren geben an, dass kein Interessenkonflikt besteht.
Figures




Similar articles
-
The New Era of Cancer Immunotherapy: Manipulating T-Cell Activity to Overcome Malignancy.Adv Cancer Res. 2015;128:1-68. doi: 10.1016/bs.acr.2015.04.010. Epub 2015 Jun 9. Adv Cancer Res. 2015. PMID: 26216629 Review.
-
Cancer immunotherapy: the beginning of the end of cancer?BMC Med. 2016 May 5;14:73. doi: 10.1186/s12916-016-0623-5. BMC Med. 2016. PMID: 27151159 Free PMC article. Review.
-
Immunomodulating and Immunoresistance Properties of Cancer-Initiating Cells: Implications for the Clinical Success of Immunotherapy.Immunol Invest. 2017 Apr;46(3):221-238. doi: 10.1080/08820139.2017.1280051. Epub 2017 Mar 13. Immunol Invest. 2017. PMID: 28287848 Review.
-
Oncolytic Immunotherapy for Treatment of Cancer.Adv Exp Med Biol. 2016;909:241-83. doi: 10.1007/978-94-017-7555-7_5. Adv Exp Med Biol. 2016. PMID: 27240460 Review.
-
Future approaches in immunotherapy.Semin Oncol. 2014 Oct;41 Suppl 5:S30-40. doi: 10.1053/j.seminoncol.2014.09.005. Epub 2014 Sep 7. Semin Oncol. 2014. PMID: 25438998 Review.
References
-
- Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science (New York, NY) 2013;342:1432–1433. - PubMed
-
- Mantovani A, Sozzani S, Locati M et al.Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends in immunology. 2002;23:549–555. - PubMed
Publication types
MeSH terms
LinkOut - more resources
Full Text Sources
Other Literature Sources
Miscellaneous

