Abstract
组织工程被认为是未来针对工程化组织缺损进行修复及功能性重建的有效手段之一。仿生生物支架为种子细胞的增殖分化和组织再生提供了理想的支持与空间,而这些支架的表面特性特别是表面纳米拓扑结构成为决定植入能否成功的关键。间充质干细胞(MSC)被公认为理想的组织工程种子细胞,而纳米拓扑结构可以调节 MSC 的细胞行为和分化潜能。本文综述了近年来纳米拓扑结构在 MSC 构建工程化组织中的应用与发展。
Keywords: 纳米拓扑结构, 间充质干细胞, 组织工程, 纳米技术
Abstract
Tissue engineering has emerged as a promising approach for the repair and functional reconstruction of damaged tissues. The bionic and intelligentized scaffolds provide the structural support for cell growth and differentiation as well as tissue regeneration. The surface properties of the biological material implant, the nanotopology in particular, become key aspects in determining the success of the implant. Mesenchymal stem cells (MSC) are widely favored by researchers as the seed cells in tissue engineering. Recently, it has been shown that nanotopographical characteristics of biomaterials regulate a wide range of MSC properties from their cellular behavior and differentiation potential. Herein, this review will provide an update on studies investigating the roles of nanotopography in the development of tissue engineering using MSC.
Keywords: nanotopography, mesenchymal stem cell, tissue engineering, nanotechnology
引言
多种原因导致的组织缺损或功能障碍是危害人类生命健康的主要原因。组织移植转移和假体置换等传统疗法存在着诸如组织短缺、疾病传播和生物相容性问题等缺点[1]。作为再生医学的重要组成部分,组织工程可以避免“以创伤修复创伤”的传统治疗模式,展现出广阔的应用前景。种子细胞、生物支架材料和组织构建是组织工程最基本的三大要素。应用于组织构建的生物支架材料必须与种子细胞有良好的亲和性并能为种子细胞提供支撑,材料的表面特征尤其是纳米拓扑结构是决定植入物在体表和体内大部分生物学反应的关键因素。作为组织工程的种子细胞来源,间充质干细胞(mesenchymal stem cells,MSC)具有多向分化的潜能,而纳米拓扑结构可以调节 MSC 相关基因的表达并影响其细胞行为。因此,运用组织工程的方法利用纳米拓扑结构引导 MSC 的增殖、分化和特定功能基因的表达就显得尤为重要。近年来,研究人员利用纳米材料开展包括皮肤、软骨、骨、肌肉等多种组织的构建,取得了一系列重要进展。本文将着重介绍纳米拓扑结构在 MSC 构建工程化组织中的应用和发展。
1. MSC 在组织工程中的优势和应用
1.1. MSC 的特点
MSC 来源于发育早期的中胚层和外胚层,属于多能干细胞。MSC 在体内或体外特定诱导条件下,可分化形成骨、软骨、肌肉、脂肪、肌腱、神经、心肌、内皮等多种组织细胞,进行连续传代培养和冷冻保存后仍具有多向分化潜能,且本身来源易获得、易于分离,体外培养时扩增迅速,并具有免疫调节和自我更新能力。这些特点使得 MSC 成为组织工程和再生医学研究中理想的种子细胞。
1.2. MSC 在组织工程中的应用
MSC 不仅能够分化形成多种细胞类型,还能通过分泌细胞因子和趋化因子提供基质支持,参与修复因衰老和病变引起的组织损伤,促进细胞与移植组织的整合。MSC 在骨、软骨、肝脏、肌腱、心脏等组织工程领域应用广泛,可用于治疗成骨不全、骨质疏松等骨骼系统疾病及修复损伤性关节软骨。MSC 与生物支架复合使用,更有利于发挥其优势,促进组织的修复和重建,在治疗局部骨缺损方面很有前途。
2. 纳米拓扑结构在组织工程中的应用
2.1. 纳米材料和纳米拓扑结构
纳米材料指的是在三维空间中至少有一维处于纳米尺度范围(即 1~100 nm)或由这个纳米尺度范围为基本单位组成的材料。纳米拓扑结构特指纳米尺度的拓扑结构,即在纳米范围内(通常为 1~100 nm,有时多达数百纳米)材料表面的形貌特征[2],包括纳米凹槽、纳米矩阵、纳米岛、纳米点、纳米孔、纳米柱、纳米管等。图 1列举了三种典型的纳米拓扑结构。
图 1.
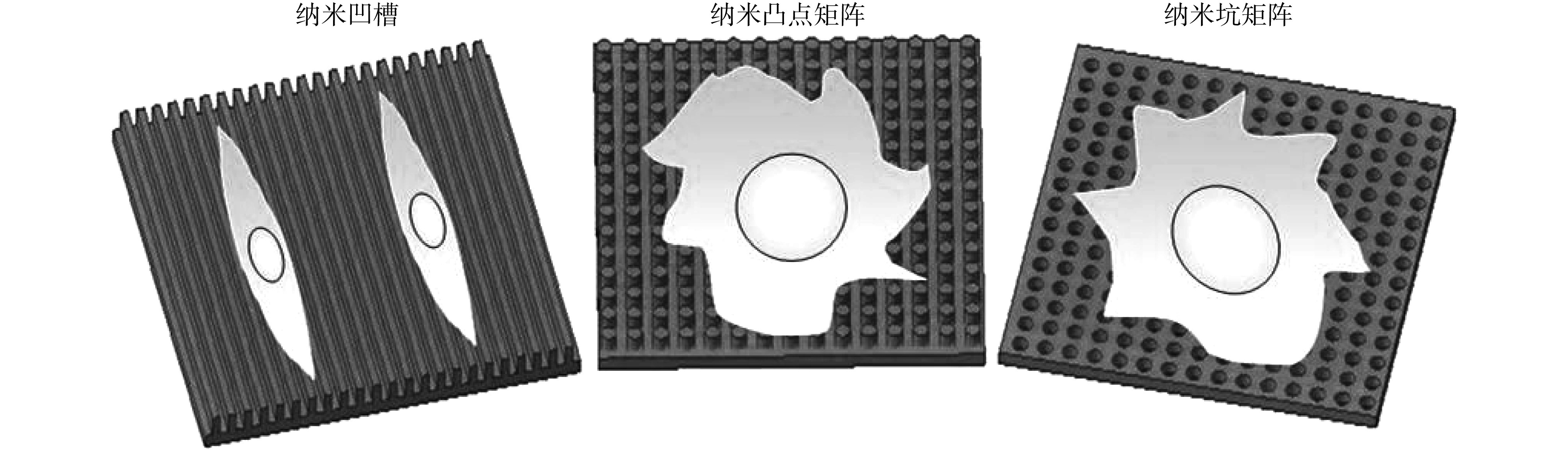
Three basic nanotopography geometries
三种典型的纳米拓扑结构
2.2. 纳米拓扑结构的制造方法
目前,支架材料表面纳米拓扑结构的制造方法主要有四种:平板压印、图案转移、表面粗化、材料合成。平板压印和图案转移是利用预先确定好的图案模型自上而下地在二维结构表面制造纳米拓扑特征的两种方法。与之相反,表面粗化和材料合成则利用化学或物理方法自下而上地在材料表面直接制造出纳米拓扑结构。
平板压印技术包括光刻技术、电子束光刻技术和胶体平板压印。图案转移分为纳米压印和模塑复制。表面粗化指利用化学腐蚀、反应离子刻蚀和气相沉淀加工生成随机的纳米拓扑结构。材料合成则包括不同的材料合成方法,如静电纺丝、相分离、自组装、阳极氧化和烧结都可以用于制造生物材料的纳米拓扑结构[3]。
2.3. 纳米拓扑结构在构建工程化组织中的应用
复合材料形成的纳米拓扑支架由于其良好的生物兼容性、延展性、热稳定性,为种子细胞的黏附和增殖提供良好的兼容条件,在工程化组织的构建中应用广泛。例如,纳米羟基磷灰石/纤维素支架具有良好的热稳定性和刚度,且支架的纳米纤维能很好地模拟天然胞外基质,有效提高细胞的黏附和增殖能力,在骨组织工程中具有极大的发展潜能[4];纳米羟基磷灰石/壳聚糖支架的化学性能与天然骨组织、牙齿相类似,其表面的拓扑结构有效提高了碱性磷酸酶活性和骨结合能力,已被用于牙齿修复和骨组织工程[5-6]。与传统支架相比,复合纳米支架表面的软骨细胞存活、增殖能力更强,有望成为鼻中隔软骨的理想支架[7]。此外,具有多孔拓扑结构的银/羟乙基纤维素支架凭借良好的可降解性、高吸水性和低毒性成为皮肤组织工程的理想材料[8]。具有纳米凹槽结构的复合支架则能更好地模拟人体内的湿度环境,且具有良好的力学性能可以有效维持血管的收缩性,调节血管平滑肌细胞的应答反应,表现出作为血管支架的潜质[9]。
3. 纳米拓扑结构影响 MSC 细胞生物学行为的机制
MSC 作为组织工程的种子细胞,不仅接触到培养液和所添加的生长因子,还能通过“接触诱导”感应支架材料的拓扑结构。纳米拓扑结构可以模仿细胞外基质的结构和生物功能,通过调节黏着斑连接和控制特定蛋白吸附等方式影响一系列细胞行为,包括细胞黏附、形态、增殖、迁移、基因表达、蛋白分泌、自我更新和分化等[2-3]。
3.1. 调节黏着斑的连接
黏着斑通过整联蛋白将细胞骨架、细胞核与胞外基质相连接。材料表面的纳米拓扑结构形成的不同尺寸和间距,可以直接影响材料表面整联蛋白的结构及聚合能力,进而影响黏着斑形成,改变黏着斑的排列和大小,调节黏着斑的连接。黏着斑引导肌动蛋白调整细胞骨架,细胞骨架将所感受到的力学信号传导至细胞核,启动染色体上相关基因表达,最终调控细胞黏附、生长及分化等行为[2, 10]。纳米拓扑结构还能加强整联蛋白和支架材料间的相互作用,提高细胞的伸展性,上调黏着斑激酶(focal adhesion kinase,FAK)和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)的表达,改变 FAK 的磷酸化水平和Ⅱ型肌球蛋白(myosin Ⅱ)的收缩性[11]。磷酸化的 FAK 能够上调神经元标记物——微管相关蛋白 2(microtubule-associated protein-2,MAP-2)的表达,有利于 MSC 向神经元分化[10]。研究发现纳米凸点矩阵结构的高度小于 70 nm 最利于黏着斑蛋白的聚集,当高度大于 70 nm 时,形成的黏着斑则处于非稳定状态,并且抑制黏着斑的蛋白聚合[3, 12],不利于 MSC 细胞的黏附、增殖、分化。
3.2. 控制特定蛋白的吸附
支架材料与细胞接触后,首先发生蛋白吸附现象,特定蛋白如纤连蛋白(fibronectin)、层连蛋白(laminin)、玻连蛋白(vitronectin)可以指导细胞骨架纤维的组装,促进细胞黏附、增殖、迁移,控制细胞行为。相对于平滑的支架表面,纳米拓扑结构支架能够延长蛋白在其表面的停留时间,增加蛋白吸附面积,减少蛋白单体之间的距离,便于蛋白单体聚合。纳米拓扑结构通过增加支架的表面积、增大表面的粗糙度、改变支架材料的亲水性来提高这些特定蛋白的吸附能力,但对白蛋白(albumin)和纤维蛋白原(fibrinogen)的吸附没有影响[2]。普遍认为只有当纳米拓扑结构的尺寸与特定蛋白大小相似、接近 10 nm 时,才会影响相关蛋白的活性,促进细胞黏附和增殖,如改变纤连蛋白的空间结构,调节成骨细胞的黏附能力[13]。除纳米拓扑结构之外,支架材料的理化特性(包括硬度、刚度、热稳定性、生物相容性等特性)也可以影响支架表面特定蛋白的聚合,进而调控 MSC 的多种细胞行为和分化方向。反之,当材料表面的化学性质和亲水性发生改变时,拓扑结构将会失去对蛋白吸附的调节作用,无法参与调控 MSC 的各项细胞行为[2]。
4. 纳米拓扑结构引导 MSC 在构建工程化组织中的应用
4.1. 骨
由于骨感染、骨肿瘤和骨损伤等骨骼疾病多发,而自体骨组织来源有限,造成骨来源大量缺乏。与传统材料相比,纳米材料的仿生特性和优异的理化性能更有利于细胞黏附,刺激新骨生长,在重塑骨组织过程中起着重要作用。
细胞在组织支架中的生长形态受支架结构的影响,而细胞的形态会影响分化方向,如 MSC 呈扁平状铺展开时会分化成成骨细胞[14]。黏着斑的数量、排列顺序和支架表面拓扑结构的对称性、尺寸大小都可以影响 MSC 的增殖和成骨分化[15-17]。支架材料的纳米坑矩阵结构的对称性和排列顺序对 MSC 表达特定成骨蛋白[包括骨钙蛋白(osteocalcin)和骨桥蛋白(osteopontin)]有重要作用[16]。不同直径的纳米凸点矩阵结构和纳米管结构对 MSC 的形态、增殖、成骨分化都有影响[15, 17]。经过拉伸的纳米孔结构能够引起 MSC 细胞骨架改变,高表达成骨基因并激活 Smad 信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路[18]。而纳米凹槽的表面结构本身虽然并不能直接诱导 MSC 分化为成骨细胞,但可以在其分化过程中提供支撑媒介,改变 MSC 细胞的形态,使其更易分化为成骨细胞[19]。
此外,生物活性材料与纳米拓扑结构联合应用对 MSC 的附着、增殖和分化有促进作用。比如,覆盖有生物活性涂层的纳米岛结构表面可为 MSC 附着和增殖提供很好的支撑,显著促进 MSC 成骨分化,表达多个成骨关键基因[20]。
4.2. 软骨
关节软骨损伤后自我修复能力有限,且容易发展为骨关节炎。尽早进行干预可以预防创伤性软骨损伤发展为软骨退化和骨关节炎,有效减少医疗成本和患者痛苦。因此,纳米拓扑结构引导 MSC 用于治疗软骨创伤以及膝盖、脚踝和骨关节的软骨缺损具有很好的临床应用前景[21-22]。
有研究证明,圆润、球形的 MSC 形态可以增加软骨相关基因及蛋白的表达,加快软骨的形成率[23]。使用垂直于纳米纤维的微流体对 MSC 进行刺激,能使 MSC 具有圆润的形态,有利于 MSC 在软骨分化中纤维软骨的增生[24]。然而,MSC 对材料表面的纳米拓扑结构很敏感,在不同的纳米结构上表现出不同的形态学、增殖和软骨形成能力。例如,纳米柱和纳米孔可以提高 MSC 软骨分化能力,促进透明软骨的形成,而纳米凹槽则会延迟软骨形成[25]。MSC 的分化方向对不同的纳米拓扑结构具有倾向性:在成脂诱导条件下,MSC 在聚己内酯纳米丝表面的脂肪分化能力强于在相同材料光滑表面的成脂能力;但在成软骨诱导条件下,MSC 在光滑表面的软骨分化能力却更强[26]。这些研究提示并不是所有类型的纳米拓扑结构都能促进 MSC 向特定方向分化,还需要进一步的研究。
4.3. 皮肤
每年,临床上需要大量的皮肤用于烧伤治疗和整形美容,然而皮肤自身的修复能力有限,于是皮肤组织工程应运而生。MSC 具有分化为上皮细胞的能力,可以帮助、改善皮肤的愈合和再生,在治疗皮肤创伤特别是慢性、难愈性伤口中已取得一定的成果。在其治疗骨创伤时也证明它可以加速伤口闭合、上皮修复和血管结构再生[27]。MSC 整合到一个模仿天然皮肤微环境和细胞外基质的纳米纤维支架上,可以提高皮肤修复或再生的机会[28]。有研究表明,MSC 在纳米凹槽拓扑结构上迁移到受损细胞部位的速度快于二维平面培养,且 MSC 迁移的速度与纳米凹槽的密度成正比,但增殖速度与其在二维平面培养时无明显差异[29]。
研究发现具有多孔网格结构的超细纳米纤维可以产生类似于天然皮肤胞外基质的纳米拓扑结构。因此,目前很多研究集中在电纺丝纳米纤维在皮肤组织工程上的应用[28, 30]。纳米纤维可以增强 MSC 与支架材料的相互作用,更好地诱导 MSC 定向分化成表皮细胞[31]。这些研究的深入为重建皮肤组织工程提供了参考和指导作用。
4.4. 肌肉
人类所有运动都需要肌肉组织的参与,由于疾病、运动等原因造成的肌肉组织损伤严重影响着患者的日常生活。肌肉组织工程的发展为克服自体肌肉组织来源有限和提高肌肉再生能力提供了一个有效的选择。在组织支架的表面引入尺寸适宜的拓扑结构,能使细胞产生特异性应答。研究发现具有单一高度纳米界面和不同高度纳米界面混合排列的纳米凹槽结构都可以提高 MSC 的增殖能力,并诱导 MSC 分化成具有收缩性的平滑肌细胞,还可以促进内皮细胞黏附和增殖[31]。
由于纳米纤维支架表面的多孔结构能更好地促进细胞渗入,减少宿主应答反应,在重建肌肉组织中也多有应用。纳米纤维可以调控肌动蛋白和 MSC 的细胞核形态,在没有水溶性诱导因子的情况下引导 MSC 向心肌细胞分化[3]。Moghadasi 等[32]将转录生长因子β1(transforming growth factor-β1,TGF-β1)密封于嵌入纳米纤维的纳米颗粒内,纳米纤维的表面拓扑结构可以使 TGF-β1 持续缓慢释放,两者协同作用,提高 MSC 分化成为平滑肌细胞的能力,增强平滑肌标志分子α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和结蛋白(desmin)的表达。这些研究为重新恢复因疾病、衰老而衰退的肌肉组织功能提供了希望。
5. 讨论和展望
纳米技术和纳米材料加工方法的快速发展使得支架材料表面的纳米拓扑结构尺寸和形状更为精密,生物相容性更好。大多数纳米拓扑结构更倾向于引导 MSC 向单一方向分化。然而,某些纳米拓扑结构却存在着广谱作用。例如,纳米凹槽结构有利于 MSC 向成骨、平滑肌方向分化,且能提高 MSC 在其表面的迁移速度。由高分子复合材料形成的纳米岛结构不但可以诱导 MSC 向成骨、软骨、脂肪等多种方向分化,而且还能有效刺激细胞增殖和促进组织再生[33]。探索其中的机制将为相关纳米拓扑结构支架日后进入临床应用阶段提供理论基础。
大多数的研究结果表明各种纳米拓扑结构对 MSC 生长和分化有积极作用。然而,也有证据显示某些类型的纳米拓扑结构可能对机体产生不良反应。例如,纳米凹槽不利于 MSC 分化为软骨细胞,也不适用于软骨修复或再生。另外,随着植入体内的时间延长,纳米材料会发生腐蚀并在植入物附近释放出纳米颗粒。由于这些颗粒粒子的表面特性,会吸附它们附近的大分子,导致纳米颗粒表面性能发生改变,对细胞形态、黏附、增殖和分化造成毒副作用[27]。此外,纳米拓扑结构在诸如心脏、肾脏、膀胱等复杂器官中的应用潜能仍然缺乏大规模的研究。
今后,科学家们将致力于开发具有精密纳米拓扑结构的材料引导 MSC 向更复杂的组织、器官分化,并对被腐蚀的纳米拓扑结构表面释放的纳米颗粒的毒性和纳米拓扑结构的广谱作用进行更为全面的分析和探索。相信纳米拓扑支架将为新一代功能性组织、器官的发展打开大门,更好地造福于人类。
Funding Statement
国家自然科学基金项目(81470862);中国科学院战略生物资源服务网络计划项目(ZSSB-003,CZBZX-1)
References
- 1.Jiang Weicheng, Cheng Yuhao, Yen M H, et al Cryo-chemical decellularization of the whole liver for mesenchymal stem cells-based functional hepatic tissue engineering. Biomaterials. 2014;35(11):3607–3617. doi: 10.1016/j.biomaterials.2014.01.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Yang Lei, Liu Haipei, Lin Yuan Biomaterial nanotopography-mediated cell responses: experiment and modeling. Int J Smart Nano Mater. 2015;5(4):227–256. [Google Scholar]
- 3.Chen Weiqiang, Shao Yue, Li Xiang, et al Nanotopographical surfaces for stem cell fate control: Engineering mechanobiology from the Bottom. Nano Today. 2014;9(6):759–784. doi: 10.1016/j.nantod.2014.12.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Ao Chenghong, Niu Yan, Zhang Ximu, et al Fabrication and characterization of electrospun cellulose/nano-hydroxyapatite nanofibers for bone tissue engineering. Int J Biol Macromol. 2017;97:568–573. doi: 10.1016/j.ijbiomac.2016.12.091. [DOI] [PubMed] [Google Scholar]
- 5.Shahnavazi M, Ketabi M A, Fekrazad R, et al Fabrication of Chitosan-nano hydroxyapatite scaffold for dental tissue engineering. Key Eng Mater. 2017;720:223–227. [Google Scholar]
- 6.Atak B H, Buyuk B, Huysal M, et al Preparation and characterization of amine functional nano-hydroxyapatite/chitosan bionanocomposite for bone tissue engineering applications. Carbohydr Polym. 2017;164:200–213. doi: 10.1016/j.carbpol.2017.01.100. [DOI] [PubMed] [Google Scholar]
- 7.Oseni A O, Butler P E, Seifalian A M The application of POSS nanostructures in cartilage tissue engineering: the chondrocyte response to nanoscale geometry. J Tissue Eng Regen Med. 2015;9(11):E27–E38. doi: 10.1002/term.1693. [DOI] [PubMed] [Google Scholar]
- 8.Zulkifli F H, Hussain F S J, Zeyohannes S S, et al A facile synthesis method of hydroxyethyl cellulose-silver nanoparticle scaffolds for skin tissue engineering applications. Mater Sci Eng C Mater Biol Appl. 2017;79:151–160. doi: 10.1016/j.msec.2017.05.028. [DOI] [PubMed] [Google Scholar]
- 9.Yang H S, Lee B, Tsui J H, et al Electroconductive nanopatterned substrates for enhanced myogenic differentiation and maturation. Adv Healthc Mater. 2016;5(1):137–145. doi: 10.1002/adhm.201500003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Teo B K, Wong S T, Lim C K, et al Nanotopography modulates mechanotransduction of stem cells and induces differentiation through focal adhesion kinase. ACS Nano. 2013;7(6):4785–4798. doi: 10.1021/nn304966z. [DOI] [PubMed] [Google Scholar]
- 11.Biggs M J, Richards R G, Gadegaard N, et al Interactions with nanoscale topography: adhesion quantification and signal transduction in cells of osteogenic and multipotent lineage. J Biomed Mater Res A. 2009;91(1):195–208. doi: 10.1002/jbm.a.32196. [DOI] [PubMed] [Google Scholar]
- 12.Loger K, Engel A, Haupt J, et al Cell adhesion on NiTi thin film sputter-deposited meshes. Mater Sci Eng C Mater Biol Appl. 2016;59:611–616. doi: 10.1016/j.msec.2015.10.008. [DOI] [PubMed] [Google Scholar]
- 13.Lin Manping, Wang Huaiyu, Ruan Changshun, et al Adsorption force of fibronectin on various surface chemistries and its vital role in osteoblast adhesion. Biomacromolecules. 2015;16(3):973–984. doi: 10.1021/bm501873g. [DOI] [PubMed] [Google Scholar]
- 14.Mcbeath R, Pirone D M, Nelson C M, et al Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Dev Cell. 2004;6(4):483–495. doi: 10.1016/s1534-5807(04)00075-9. [DOI] [PubMed] [Google Scholar]
- 15.de Peppo G M, Agheli H, Karlsson C, et al Osteogenic response of human mesenchymal stem cells to well-defined nanoscale topography in vitro. Int J Nanomedicine. 2014;9(1):2499–2515. doi: 10.2147/IJN.S58805. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Luo Yu, Shen He, Fang Yongxiang, et al Enhanced proliferation and osteogenic differentiation of mesenchymal stem cells on graphene oxide-incorporated electrospun poly(lactic-co-glycolic acid) nanofibrous mats. ACS Appl Mater Interfaces. 2015;7(11):6331–6339. doi: 10.1021/acsami.5b00862. [DOI] [PubMed] [Google Scholar]
- 17.Hosseinkhani H, Hosseinkhani M, Kobayashi H Proliferation and differentiation of mesenchymal stem cells using self-assembled peptide amphiphile nanofibers. Biomed Mater. 2006;1(1):8–15. doi: 10.1088/1748-6041/1/1/002. [DOI] [PubMed] [Google Scholar]
- 18.Xiao Qianru, Zhang Ning, Wang Xi, et al. Oriented surface nanotopography promotes the osteogenesis of mesenchymal stem cells. Adv Mater Interface, 2016. DOI: 10.1002/admi.201600652
- 19.Abagnale G, Steger M, Nguyen V H, et al Surface topography enhances differentiation of mesenchymal stem cells towards osteogenic and adipogenic lineages. Biomaterials. 2015;61:316–326. doi: 10.1016/j.biomaterials.2015.05.030. [DOI] [PubMed] [Google Scholar]
- 20.McCafferty M M, Burke G A, Meenan B J Calcium phosphate thin films enhance the response of human mesenchymal stem cells to nanostructured Titanium surfaces. J Tissue Eng. 2014;5:2041731414537513. doi: 10.1177/2041731414537513. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Baboolal T G, Mastbergen S C, Jones E, et al Synovial fluid hyaluronan mediates MSC attachment to cartilage, a potential novel mechanism contributing to cartilage repair in osteoarthritis using knee joint distraction. Ann Rheum Dis. 2016;75(5):908–915. doi: 10.1136/annrheumdis-2014-206847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Toh W S, Lai R C, Hui J H, et al MSC exosome as a cell-free MSC therapy for cartilage regeneration: Implications for osteoarthritis treatment. Semin Cell Dev Biol. 2017;67:56–64. doi: 10.1016/j.semcdb.2016.11.008. [DOI] [PubMed] [Google Scholar]
- 23.Gao Lin, Mcbeath R, Chen C S Stem cell shape regulates a chondrogenic versus myogenic fate through Rac1 and N-cadherin. Stem Cells. 2010;28(3):564–572. doi: 10.1002/stem.308. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Zhong Weiliang, Zhang Weiguo, Wang Shouyu, et al Regulation of fibrochondrogenesis of mesenchymal stem cells in an integrated microfluidic platform embedded with biomimetic nanofibrous scaffolds. PLoS One. 2013;8(4):e61283. doi: 10.1371/journal.pone.0061283. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Wu Yingnan, Law J B, He Aiyu, et al Substrate topography determines the fate of chondrogenesis from human mesenchymal stem cells resulting in specific cartilage phenotype formation. Nanomedicine. 2014;10(7):1507–1516. doi: 10.1016/j.nano.2014.04.002. [DOI] [PubMed] [Google Scholar]
- 26.Trujillo N A, Popat K C Increased adipogenic and decreased chondrogenic differentiation of adipose derived stem cells on nanowire surfaces. Materials (Basel, Switzerland) 2014;7(4):2605–2630. doi: 10.3390/ma7042605. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Salmasi S, Kalaskar D M, Yoon W W, et al Role of nanotopography in the development of tissue engineered 3D organs and tissues using mesenchymal stem cells. World J Stem Cells. 2015;7(2):266–280. doi: 10.4252/wjsc.v7.i2.266. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sundaramurthi D, Krishnan U M, Sethuraman S Electrospun nanofibers as scaffolds for skin tissue engineering. Polymer Reviews. 2014;54(2):348–376. [Google Scholar]
- 29.Kim J, Kim H N, Lim K T, et al Designing nanotopographical density of extracellular matrix for controlled morphology and function of human mesenchymal stem cells. Sci Rep. 2013;3:3552. doi: 10.1038/srep03552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Jin G, Prabhakaran M P, Ramakrishna S Stem cell differentiation to epidermal lineages on electrospun nanofibrous substrates for skin tissue engineering. Acta Biomater. 2011;7(8):3113–3122. doi: 10.1016/j.actbio.2011.04.017. [DOI] [PubMed] [Google Scholar]
- 31.Li Jingan, Qin Wei, Zhang Kun, et al Controlling mesenchymal stem cells differentiate into contractile smooth muscle cells on a TiO2 micro/nano interface: Towards benign pericytes environment for endothelialization . Colloids Surf B Biointerfaces. 2016;145:410–419. doi: 10.1016/j.colsurfb.2016.05.024. [DOI] [PubMed] [Google Scholar]
- 32.Moghadasi Boroujeni S, Mashayekhan S, Vakilian S, et al The synergistic effect of surface topography and sustained release of TGF-β1 on myogenic differentiation of human mesenchymal stem cells. J Biomed Mater Res A. 2016;104(7):1610–1621. doi: 10.1002/jbm.a.35686. [DOI] [PubMed] [Google Scholar]
- 33.Khattak M, Pu Fanrong, Curran J M, et al Human mesenchymal stem cell response to poly(ε-caprolactone/poly(methyl methacrylate) demixed thin films. J Mater Sci Mater Med. 2015;26(5):178. doi: 10.1007/s10856-015-5507-2. [DOI] [PubMed] [Google Scholar]


