HCoV-NL63 and HCoV-HKU1 seroprevalence and its relationship with the clinical features of COVID-19 patients from Villavicencio, Colombia
- PMID: 39241243
- PMCID: PMC11500678
- DOI: 10.7705/biomedica.7168
HCoV-NL63 and HCoV-HKU1 seroprevalence and its relationship with the clinical features of COVID-19 patients from Villavicencio, Colombia
Abstract
Introduction: Due to the cross-reactivity between SARS-CoV-2 and common human coronaviruses, previous infections with these viruses could contribute to serological or cellular cross-protection against severe COVID-19. However, protective immunity may not develop, or pre-existing immunity could increase COVID-19 severity.
Objective: To determine the seroprevalence of IgG antibodies against HCoV-NL63 and HCoV-HKU1 and correlate previous exposure with COVID-19 signs in patients from Villavicencio.
Materials and methods: A cross-sectional retrospective study was conducted. ELISA technique was used to search for IgG antibodies against HCoV-NL3 and HCoV-HKU1 in patients with positive RT-qPCR results for SARS-CoV-2. Patients were grouped according to COVID-19 clinical characteristics in four groups: group 1: asymptomatic (n = 23); group 2: hospitalized (n = 24); group 3: intensive care units (n = 24), and group 4: dead (n = 22).
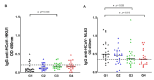
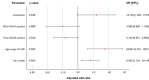
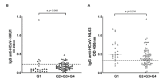
Results: The overall seroprevalence of IgG antibodies against HCoV was 74.2% (n = 69; 95% CI: 65.3-83.1), with 66.7% of HCoV-NL63 (n = 62; 95% CI: 57,1-76,2), and 25.8% of HCoV-HKU1 (n = 24; 95% CI: 16,9-34,7). Based on crosstab analysis, prior exposure to HCoV-NL63 was associated with protection against severe COVID-19 (p = 0.042; adjusted OR = 0.159; 95% CI: 0.027-0.938), and previous coinfection of HCoV-NL63 and HCoVHKU1 was considered a positive association to severe COVID-19 (p = 0.048; adjusted OR = 16.704; 95% CI: 1.020 - 273.670).
Conclusion: To our knowledge, this is the first study addressing seroprevalence of HCoV IgG antibodies in Colombia and Latin America. Previous exposure to HCoV-NL63 could protect against severe COVID-19, whereas patients with underlying HCoV-NL63 and HCoVHKU1 coinfection could be hospitalized with severe signs of COVID-19.
Introducción: Debido a la reactividad cruzada entre SARS-CoV-2 y los coronavirus humanos comunes, las infecciones previas con estos virus podrían contribuir a la protección cruzada serológica o celular contra la COVID-19 grave. Sin embargo, la inmunidad protectora puede no desarrollarse o la inmunidad preexistente podría generar COVID-19 grave.
Objetivo: Determinar la seroprevalencia de anticuerpos IgG frente a HCoV-NL63 y HCoVHKU1, y correlacionar su previa exposición con los signos de COVID-19 en pacientes de Villavicencio.
Materiales y métodos: Se realizó un estudio retrospectivo observacional analítico y transversal. Se utilizó la técnica ELISA para buscar anticuerpos IgG contra HCoV-NL3 y HCoV-HKU1 en pacientes con resultado positivo de RT-qPCR para SARS-CoV-2. Los pacientes se agruparon según los signos de COVID-19 en cuatro grupos: grupo 1: asintomáticos (n = 23); grupo 2: hospitalizados (n = 24); grupo 3: unidad de cuidados intensivos (n = 24), y grupo 4: fallecidos (n = 22).
Resultados: La seroprevalencia general de IgG anti-HCoV fue de 74.2 % (n = 69; IC95%: 65,3-83,1), con 66,7 % de HCoV-NL63 (n = 62; IC95% :57,1-76,2) y 25,8 % de HCoV-HKU1 (n = 24; [IC95%:16,9-34,7). Según el análisis de las tablas de contingencia, la exposición previa a HCoV-NL63 se asoció con protección de una COVID-19 grave (p = 0,042; OR ajustado = 0,159; IC95%: 0,027-0,938) y la previa coinfección de HCoV-NL63 y HCoV-HKU1 se asoció con padecimiento de signos clínicos graves por COVID-19 (p = 0,048; OR ajustado = 16,704; IC95%: 1,020- 73,670).
Conclusión: Según la literatura revisada hasta la fecha, este es el primer estudio sobre la seroprevalencia de anticuerpos IgG de HCoV en Colombia y Latinoamérica. La exposición previa a HCoV-NL63 podría proteger contra la COVID-19 grave, mientras que los pacientes con coinfección subyacente de HCoV-NL63 y HCoV-HKU1 podrían resultar hospitalizados con signos graves de COVID-19.
Introducción.: Debido a la reactividad cruzada entre SARS-CoV-2 y los coronavirus humanos comunes, las infecciones previas con estos virus podrían contribuir a la protección cruzada serológica o celular contra la COVID-19 grave. Sin embargo, la inmunidad protectora puede no desarrollarse o la inmunidad preexistente podría generar COVID-19 grave.
Objetivo.: Determinar la seroprevalencia de anticuerpos IgG frente a HCoV-NL63 y HCoV-HKU1, y correlacionar su previa exposición con los signos de COVID-19 en pacientes de Villavicencio.
Materiales y métodos.: Se realizó un estudio retrospectivo observacional analítico y transversal. Se utilizó la técnica ELISA para buscar anticuerpos IgG contra HCoV-NL3 y HCoV-HKU1 en pacientes con resultado positivo de RT-qPCR para SARS-CoV-2. Los pacientes se agruparon según los signos de COVID-19 en cuatro grupos: grupo 1: asintomáticos (n = 23); grupo 2: hospitalizados (n = 24); grupo 3: unidad de cuidados intensivos (n = 24), y grupo 4: fallecidos (n = 22).
Resultados.: La seroprevalencia general de IgG anti-HCoV fue de 74.2 % (n = 69; IC95%: 65,3-83,1), con 66,7 % de HCoV-NL63 (n = 62; IC95%: 57,1-76,2) y 25,8 % de HCoV-HKU1 (n = 24; [IC95%:16,9-34,7). Según el análisis de las tablas de contingencia, la exposición previa a HCoV-NL63 se asoció con protección de una COVID-19 grave (p = 0,042; OR ajustado = 0,159; IC95%: 0,027-0,938) y la previa coinfección de HCoV-NL63 y HCoV-HKU1 se asoció con padecimiento de signos clínicos graves por COVID-19 (p = 0,048; OR ajustado = 16,704; IC95%: 1,020- 73,670).
Conclusión.: Según la literatura revisada hasta la fecha, este es el primer estudio sobre la seroprevalencia de anticuerpos IgG de HCoV en Colombia y Latinoamérica. La exposición previa a HCoV-NL63 podría proteger contra la COVID-19 grave, mientras que los pacientes con coinfección subyacente de HCoV-NL63 y HCoV-HKU1 podrían resultar hospitalizados con signos graves de COVID-19.
Keywords: SARS-CoV-2; COVID-19; coronavirus humano NL63; betacoronavirus; inmunoensayo.
Conflict of interest statement
Figures
Similar articles
-
Anti-RBD IgG antibodies from endemic coronaviruses do not protect against the acquisition of SARS-CoV-2 infection among exposed uninfected individuals.Front Immunol. 2024 May 23;15:1396603. doi: 10.3389/fimmu.2024.1396603. eCollection 2024. Front Immunol. 2024. PMID: 38846944 Free PMC article.
-
Cross-reactive antibody against human coronavirus OC43 spike protein correlates with disease severity in COVID-19 patients: a retrospective study.Emerg Microbes Infect. 2021 Dec;10(1):664-676. doi: 10.1080/22221751.2021.1905488. Emerg Microbes Infect. 2021. PMID: 33734013 Free PMC article.
-
Are higher antibody levels against seasonal human coronaviruses associated with a more robust humoral immune response after SARS-CoV-2 vaccination?Front Immunol. 2022 Sep 8;13:954093. doi: 10.3389/fimmu.2022.954093. eCollection 2022. Front Immunol. 2022. PMID: 36159791 Free PMC article.
-
An overview on the seven pathogenic human coronaviruses.Rev Med Virol. 2022 Mar;32(2):e2282. doi: 10.1002/rmv.2282. Epub 2021 Aug 2. Rev Med Virol. 2022. PMID: 34339073 Review.
-
Molecular mechanisms of human coronavirus NL63 infection and replication.Virus Res. 2023 Apr 2;327:199078. doi: 10.1016/j.virusres.2023.199078. Epub 2023 Feb 22. Virus Res. 2023. PMID: 36813239 Free PMC article. Review.
References
-
- Lai MM, Perlman S, Anderson LJ. Knipe DM, Howley PM. Fields Virology. Philadelphia: Lippincott Williams & Wilkins; 2007. Coronaviridae; pp. 1305–1336.
-
- Drosten C, Günther S, Preiser W, van der Werf S, Brodt H, Becker S, et al. Identification of a novel coronavirus in patients with severe acute respiratory syndrome. N Engl J Med. 2003;(348):1967–1976. https://www.nejm.org/doi/10.1056/NEJMoa030747 - DOI - PubMed
MeSH terms
Substances
LinkOut - more resources
Full Text Sources
Medical
Miscellaneous